PENGERTIAN STEROKIMIA
Stereokimia adalah studi mengenai
molekul-molekul dalam ruang tiga dimensi, artinya bagaimana atom-atom dalam
sebuah molekul diatur dalam ruang satu terhadap ruang yang lainnya. Stereokimia
berkaitan dengan
bagaimana penataan atom-atom dalam sebuah molekul dalam ruang tiga dimensi. Perlu
diketahui bahwa sterokimia ini sangat penting, karena sterokimia ini sebuah
struktur yang memiliki rumus molekul sama hanya karena susunannya berbeda akan
mengakibatkan fungsi yang berbeda pula. Pada sterokimia struktur molekul nya
berada pada posisi yang sama hanya saja arah dari struktur molekulnya berbeda. Sterokmia
berbeda dengan isomer structur, dimana isomer struktur memiliki rumus molekul
yang sama namun struktur molekulnya berbeda dengan urutan penempatan atom-atom
yang berbeda. Bisa dikatan bahwa pada isomer struktur posisi struktur
molekulnya tidak tetap seperti pada sterokimia yang memiliki struktur mlekul
pada posisi tetap hanya saja memiliki arah yang berbeda.
Pada stereokimia terdapat tiga aspek
penting , diantaranya sebagai berikut :
1.Konformasi
molekul: Berkaitan dengan bentuk molekul dan bagaimana bentuk molekul itu diubah
akibat adanya putaran bebas disepanjang ikatan C-C tunggal.
2.Konfigurasi
berkaitan dengan Kiralitas molekul: Bagaimana penataan atom-atom disekitar atom
karbon yang mengakibatkan terjadinya
isomer.
3.Isomer
Geometrik : Terjadi karena ketegaran (rigit) dalam molekul yang
mengakibatkan adanya isomer .
II. Isomer geometri dalam alkena dan senyawa siklik
Isomer adalah senyawa-senyawa karbon
yang memiliki rumus molekul sama tetapi rumus strukturnya berbeda. Pada
senyawa hidrokarbon, rumus kimia menunjukkan jumlah atom karbon dan setiap
unsur yang terdapat dalam satu molekul senyawa. Rumus kimia senyawa propana
adalah C3H6, rumus kimia ini menunjukkan bahwa setiap
molekul propana terdiri atas tiga atom karbon dan enam atom hidrogen. Rumus
struktur molekul adalah rumus kimia yang menunjukkan cara atom-atom diikatkan
antara satu sama lain dengan ikatan kovalen dalam struktur molekul senyawa
tersebut.
Keisomeran
senyawa hidrokarbon adalah suatu fenomena, karena dua atau lebih senyawa
hidrokarbon memiliki rumus kimia yang sama, tetapi memiliki struktur molekul
yang berbeda. Struktur-struktur molekul yang berbeda tetapi rumus kimianya sama
ini disebut isomer. Terdapat 4 jenis isomer, yaitu isomer rangka, isomer
posisi, isomer fungsi, dan isomer geometri. Isomer rangka dan isomer posisi
sering disebut isomer struktur.
Isomer memiliki dua Kelas Utama
yaitu Konstitusional isomer dan stereoisomer.
·
Konstitusional
isomer
konstitusional isomer merupakan berbeda pada cara atom tersebut terhubung satu
sama lain. Sifatnya yaitu:
a) Nama IUPAC yang berbeda
b) Gugus fungsi bisa sama tau beda
c) Sifat fisik yang berbeda, sehingga
bisa dipisahkan dengan pemisahan yang didasarkan perbedaan sifat fisik seperti
distilasi
d) Sifat kimia yang berbeda. sehingga
direaksikan akan menghasilkan produk yang berbeda pula
·
Stereoisomer
hanya berbeda pada cara atom berorientasi pada ruang. Stereoisomer memiliki
nama IUPAC yang identik(kecuali kata depan seperti trans atau cis). Memiliki
gugus fungsi yang sama. Susunan dari tiga dimensi disebut konfigurasi.
Stereoisomer hanya berbeda dalam konfigurasinya.
Isomer geometri adalah
isomer yang terjadi pada dua molekul yang mempunyai rumus molekul sama, tetapi
berbeda dalam penataan atom atom dalam ruang. Selalu ingat bahwa sebenarnya
molekul molekul itu ada pada ruang tiga dimensi yang atom atomnya berikatan
dengan penataan sedemikian rupa. Isomer geometri terjadi karena ketegaran
(rigidity) dalam molekul dan hanya dijumpai dalam dua kelompok senyawa yaitu
alkena dan senyawa siklik.
Jika suatu gugus atau
atom terikat oleh ikatan sigma saja (sp3, umumnya pada senyawa yang berikatan
tunggal), maka gugus atau atom yang terikat tersebut dapat berputar sedemikian
rupa sehingga bentuk molekulnya akan selalu sama.
Contoh :
Berbeda halnya dengan
gugus atau atom yang terikat oleh ikatan rangkap dimana ada ikatan sigma dan pi
dalam molekul (sp2). Gugus atau atom ini tidak dapat berotasi tanpa mematahkan
ikatan pi –nya terlebih dahulu. Sehingga ada sifat ketegaran adalam molekul
yang menyebabkan jika letak atom atau gugusnya berbeda, maka sifat senyawa
tersebut berbeda pula. Artinya lagi kedua senyawa tersebut adalah berbeda.
Contoh :
Kedua senyawa disamping adalah berbeda dimana pada senyawa pertama letak atom Cl-nya sesisi sedangkan
pada senyawa kedua letak atom Cl-nya berbeda sisi. Senyawa pertama tidak mudah
diubah menjadi senyawa kedua, begitu juga sebaliknya karena ikatan rangkap
antara atom karbonnya berisifat tegar.
Jika dalam senyawa, dua
gugus atau atom yang sama terletak pada satu sisi ikatan pi, maka disebut
dengan cis, dan jika letaknya berlwanan disebut dengan trans.
 Perbedaan kedua senyawa
dapat dibuktikan dari perbedaan sifat fisikanya seperti titik didih kedua
senyawa yang berbeda. Senyawa cis-1,2-dikloroetena memiliki titik didh 60
derajat celsius sedangkan senyawa trans-1,2-dikloroetena memiliki titik didih
48 derajat celsius. kedua senyawa tersebut tidak bisa dikatakan sebagai isomer structural karena ikatan atom atom
dan lokasi ikatan rangkap pada kedua senyawa tersebut adalah sama sehingga
bukan merupakan isomer struktural. Pasangan senyawa diatas secara umum termasuk
ke dalam kelompok stereoisomer, yaitu senyawa yang rumus strukturnya sama
tetapi yang berbeda hanyalah penataan atom atom adalam ruang. Secara lebih
spesisfik, kedua pasangan senyawa diatas disebut berisomer geometri (cis –
trans). Hal yang perlu diingat bahwa “Senyawa
alkena yang berisomer geometri bukanlah termasuk berisomer struktural, karena
secara struktural ( letak atom atom dan posisi ikatan rangakap) adalah sama”.
Perbedaan kedua senyawa
dapat dibuktikan dari perbedaan sifat fisikanya seperti titik didih kedua
senyawa yang berbeda. Senyawa cis-1,2-dikloroetena memiliki titik didh 60
derajat celsius sedangkan senyawa trans-1,2-dikloroetena memiliki titik didih
48 derajat celsius. kedua senyawa tersebut tidak bisa dikatakan sebagai isomer structural karena ikatan atom atom
dan lokasi ikatan rangkap pada kedua senyawa tersebut adalah sama sehingga
bukan merupakan isomer struktural. Pasangan senyawa diatas secara umum termasuk
ke dalam kelompok stereoisomer, yaitu senyawa yang rumus strukturnya sama
tetapi yang berbeda hanyalah penataan atom atom adalam ruang. Secara lebih
spesisfik, kedua pasangan senyawa diatas disebut berisomer geometri (cis –
trans). Hal yang perlu diingat bahwa “Senyawa
alkena yang berisomer geometri bukanlah termasuk berisomer struktural, karena
secara struktural ( letak atom atom dan posisi ikatan rangakap) adalah sama”.
Syarat suatu senyawa yang
memiliki isomer geometri adalah tiap atom akrbon yang berikatan pi (rangkap)
harus mengikat gugus – gugus yang berlainan.
Contoh : 2 – pentena
Pada senyawa pentena
diatas, kedua atom karbon yang berikatan rangkap mengikat gugus gugus yang
berlainan. Atom karbon pertama mengikat atom H dan gugus CH3, sedangkan atom
kedua mengikat H dan gugus – CH2CH3. Senyawa pentena diatas disebut memiliki
isomer geometri.
Jika gugus atau atom yang
diikat oleh karbon yang berikatan rangkap ada yang sama, walaupun mempunyai
ikatan rangkap yang tegar dan tidak dapat berotasi, tetapi senyawa tersebut
tidak berisomer geometri.
Perhatikan senyawa
dibawah
Karbon pertama yang
berikatan rangkap sama sama mengikat atom H, sehingga bentuk pertama dan kedua
senyawa diatas adalah sama walaupun penggambaran strukturnya pada bidang datar
terlihat berbeda. Ingatlah bahwa molekul sebenarnya ada pada ruang tiga
dimensi.
Isomer geometri pada
hidrokarbon siklik
} Keterbatasan perputaran atom – atom yang
terikat pada masing – masing atom C.
} Rintangan perputaran atom – atom tidak
sebesar rintangan atom – atom yang terikat pada atom C ikatan rangkap, tetapi
lebih besar dari pada rintangan pada hidrokarbon rantai terbuka karena pengaruh
regangan sudut.
} Ikatan s pada hibridisasi sp3 mempunyai sudut 109,5o,
beberapa ikatan siklik mempunyai sudut ikatan tidak demikian.
} Besarnya rintangan akibat regangan
sebanding selisih sudut ikatan dengan 109, 5o.
} Siklopropana mempunyai sudut ikatan 60,
siklopentana 108.
} Molekul siklik besar hampir tidak ada
rintangan karena regangan
} Sikloheksana membentuk konformasi kursi
supaya sudut ikatan mendekati 109,5o.
} Dalam sikloheksana dikenal subtituen:
Aksial
à ikatan pada salah satu hidrogen terletak
dalam bidang cincin
Ekuatorial
à ikatan ke hidrogen lain yang tegak lurus
sumbu
III. KONFORMASI DAN
KIRALITAS SENYAWA RANTAI TERBUKA
a.
Konformasi senyawa rantai terbuka
Konformasi Molekul
: bentuk molekul dan bagaimana bentuk ini dapat berubah. Dalam senyawa
rantai terbuka, gugus-gugus yang terikat oleh ikatan sigma dapat berotasi
mengelilingi ikatan itu. Oleh karena itu atom-atom dalam suatu molekul rantai
terbuka dapat memiliki tak terhingga banyak posisi di dalam ruang relatif satu
terhadap yang lain. Memang etana merupakan sebuah molekul kecil, tetapi etana
dapat memiliki penataan dalam ruang secara berlain-lainan, inilah yang disebut
konformasi.
Dalam senyawa rantai terbuka gugus gugus yang terikat oleh ikatan sigma dapat berotasi mengelilingi ikatan tersebut. Oleh karena itu atom – atom dalam suatu molekul – molekul terbuka dapat memiliki tak terhingga banyak posisi di dalam ruang relatif satu terhadap yang lain. Memang etana sebuah molekul kecil, tetapi etana dapat memiliki penataan dalam ruang secara berlain – lainan, penataan tersebut disebut konformasi. Untuk mengemukakan konformasi digunakan
tiga jenis rumus : rumus dimensional, rumus bola dan pasak dan proyeksi Newman.
Suatu rumus bola dan pasak dan rumus dimensional adalah representasi 3dimensi dari model molekul suatu senyawa. Suatu proyeksi Newman adalah pandangan ujung ke ujung dari dua atom karbon saja dalam molekul itu. Ikatan yang menghubungkan kedua atom karbon ini tersembunyi.
Ketiga ikatan dari karbon depan tampak menuju ke pusat proyeksi, dan ketiga ikatan dari karbon
belakang hanya tampak sebagian.
Proyeksi Newman dapat digambar untuk molekul dengan dua atom karbon atau lebih. Karena pada tiap kali hanya dua atom karbon dapat ditunjukan dalam proyeksi itu, maka lebih dari satu
proyeksi newman dapat digambar untuk sebuah moleku. lSuatu molekul dapat memiliki beberakonformasi
atau konformasi yang berbedabeda karena disebabkan adanya rotasi mengelilingi ikatan sigma. Konformasi yang berbeda
beda itu disebut konformer (dari kata “conformational isomers”)
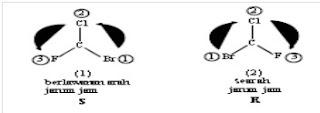
b. Kiralitas senyawa rantai
terbuka
Kiralitas adalah suatu keadaan yang menyebabkan dua molekul dengan struktur
yang sama tetapi berbeda susunan ruang dan konfigurasinya. Atom
yang menjadi pusat kiralitas dikenal dengan istilah atom kiral. Atom
kiral adalah atom yang mengikat gugus yang semuanya berbeda. Bila dalam suatu molekul terdapat satu pusat kiral maka akan terdapat dua
stereoisomer dari senyawa tersebut yang dikenal dengan istilah enantiomer.
a. Sepasang enantiomer merupakan bayangan cermin satu terhadap yang lainnya.
b. Kedua enantiomer tidak bisa ditumpangtindihkan setelah dilakukan operasi
simetri apapun.
Bila dalam satu molekul
terdapat lebih dari satu pusat kiral maka akan terdapat lebih dari satu pasang
enantiomer à
diastereoisomer/diastereomer